
附文末必看:药品注册分类常见问题答疑39个(实战经验)
2007版、2016版、2020版分类整理高清大图
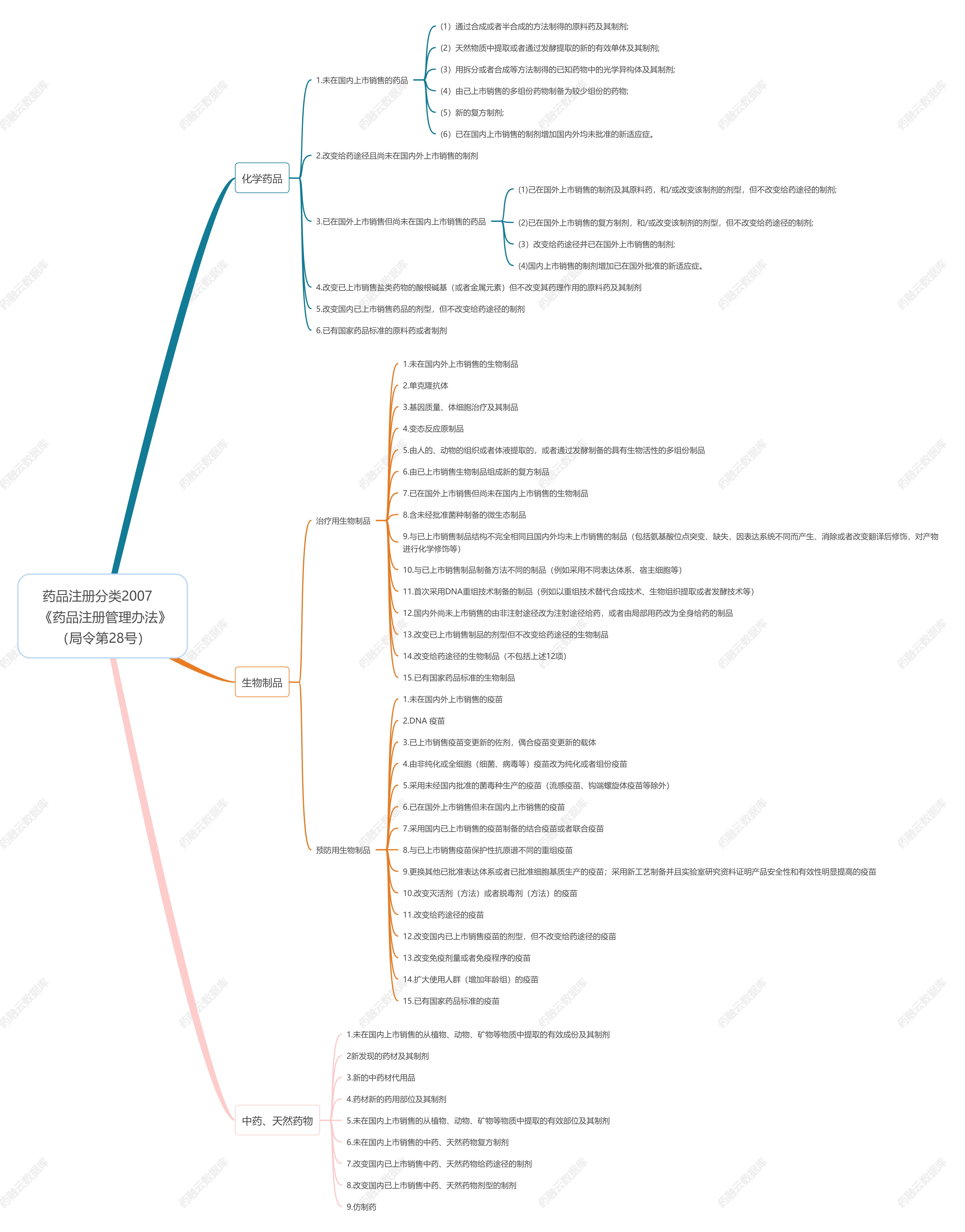
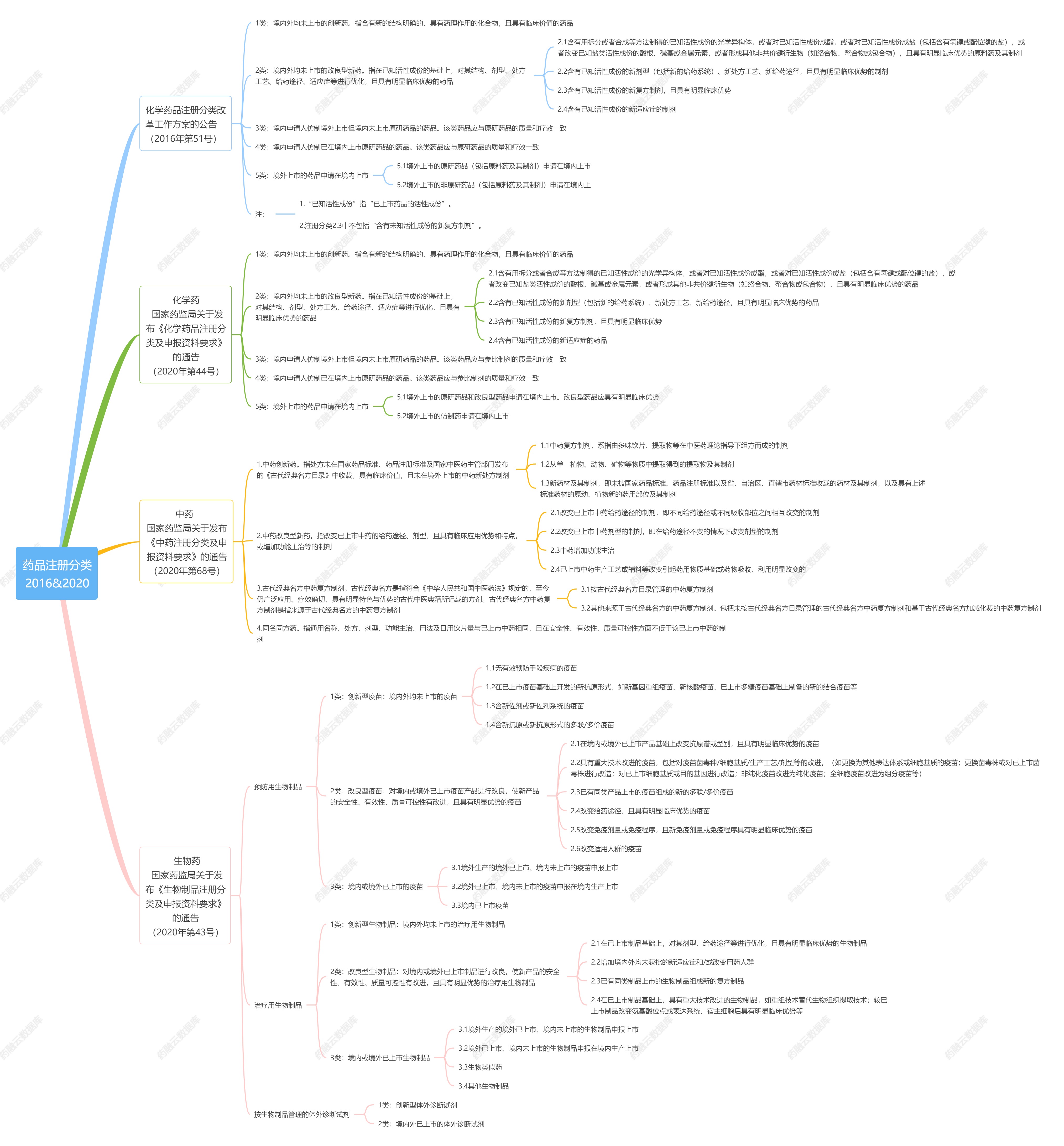
一、化学药品注册分类
化学药品注册分类分为创新药、改良型新药、仿制药、境外已上市境内未上市化学药品,分为以下5个类别:
1类:境内外均未上市的创新药。指含有新的结构明确的、具有药理作用的化合物,且具有临床价值的药品。
2类:境内外均未上市的改良型新药。指在已知活性成份的基础上,对其结构、剂型、处方工艺、给药途径、适应症等进行优化,且具有明显临床优势的药品。
2.1含有用拆分或者合成等方法制得的已知活性成份的光学异构体,或者对已知活性成份成酯,或者对已知活性成份成盐(包括含有氢键或配位键的盐),或者改变已知盐类活性成份的酸根、碱基或金属元素,或者形成其他非共价键衍生物(如络合物、螯合物或包合物),且具有明显临床优势的药品。
2.2含有已知活性成份的新剂型(包括新的给药系统)、新处方工艺、新给药途径,且具有明显临床优势的药品。
2.3含有已知活性成份的新复方制剂,且具有明显临床优势。
2.4含有已知活性成份的新适应症的药品。
3类:境内申请人仿制境外上市但境内未上市原研药品的药品。该类药品应与参比制剂的质量和疗效一致。
4类:境内申请人仿制已在境内上市原研药品的药品。该类药品应与参比制剂的质量和疗效一致。
5类:境外上市的药品申请在境内上市。
5.1境外上市的原研药品和改良型药品申请在境内上市。改良型药品应具有明显临床优势。
5.2境外上市的仿制药申请在境内上市。
原研药品是指境内外首个获准上市,且具有完整和充分的安全性、有效性数据作为上市依据的药品。
参比制剂是指经国家药品监管部门评估确认的仿制药研制使用的对照药品。参比制剂的遴选与公布按照国家药品监管部门相关规定执行。
二、相关注册管理要求
(一)化学药品1类为创新药,应含有新的结构明确的、具有药理作用的化合物,且具有临床价值,不包括改良型新药中2.1类的药品。含有新的结构明确的、具有药理作用的化合物的新复方制剂,应按照化学药品1类申报。
(二)化学药品2类为改良型新药,在已知活性成份基础上进行优化,应比改良前具有明显临床优势。已知活性成份指境内或境外已上市药品的活性成份。该类药品同时符合多个情形要求的,须在申报时一并予以说明。
(三)化学药品3类为境内生产的仿制境外已上市境内未上市原研药品的药品,具有与参比制剂相同的活性成份、剂型、规格、适应症、给药途径和用法用量,并证明质量和疗效与参比制剂一致。
有充分研究数据证明合理性的情况下,规格和用法用量可以与参比制剂不一致。
(四)化学药品4类为境内生产的仿制境内已上市原研药品的药品,具有与参比制剂相同的活性成份、剂型、规格、适应症、给药途径和用法用量,并证明质量和疗效与参比制剂一致。
(五)化学药品5类为境外上市的药品申请在境内上市,包括境内外生产的药品。其中化学药品5.1类为原研药品和改良型药品,改良型药品在已知活性成份基础上进行优化,应比改良前具有明显临床优势;化学药品5.2类为仿制药,应证明与参比制剂质量和疗效一致,技术要求与化学药品3类、4类相同。境内外同步研发的境外生产仿制药,应按照化学药品5.2类申报,如申报临床试验,不要求提供允许药品上市销售证明文件。
(六)已上市药品增加境外已批准境内未批准的适应症按照药物临床试验和上市许可申请通道进行申报。
(七)药品上市申请审评审批期间,药品注册分类和技术要求不因相同活性成份的制剂在境内外获准上市而发生变化。药品注册分类在提出上市申请时确定。
三、申报资料要求
(一)申请人提出药物临床试验、药品上市注册及化学原料药申请,应按照国家药品监管部门公布的相关技术指导原则的有关要求开展研究,并按照现行版《M4:人用药物注册申请通用技术文档(CTD)》(以下简称CTD)格式编号及项目顺序整理并提交申报资料。不适用的项目可合理缺项,但应标明不适用并说明理由。
(二)申请人在完成临床试验提出药品上市注册申请时,应在CTD基础上提交电子临床试验数据库。数据库格式以及相关文件等具体要求见临床试验数据递交相关指导原则。
(三)国家药监局药审中心将根据药品审评工作需要,结合ICH技术指导原则修订情况,及时更新CTD文件并在中心网站发布。
药品注册分类常见问题39个
Q1: 如果一个药品有两个规格,一个已经在国内上市,另一个是原研但未进口,注册分类是否都是4类?
A1: 在适应症和用法用量一致的情况下,是的,注册分类是按照品种而不是规格来划分的。
Q2: 化药3类和4类的主要区别是什么?如果原研产品有一个规格在中国上市,而我们仿制的规格并未在中国上市,我们的仿制药应该按照哪一类申报?
A2: 如果适应症和用法用量相同,所有规格可以按4类申报。如果仅仿制国内未上市的规格,则按3类申报;如果仿制国内和国外上市的规格,按4类申报。
Q3: 我们的产品原研未进口,但已在国内地产化,我们仿制申报应该按照哪一类?
A3: 如果地产化的适应症与原研一致,则为4类;如果不一致,根据申报的适应症与原研或地产化产品一致的情况,可能是3类或4类。
Q4: 原研未进口,但国内已批准仿制药上市,再申报应按照哪一类?
A4: 以原研为准,如果原研未在国内上市,则为3类。
Q5: 以前的化药1.6类新药,现在对应的应该是哪一类新药?
A5: 原先的化药1.6类新药,现在对应的应该是2.4类新药,如果该化合物具有临床价值,则可按1类申报。
Q6: 一个注射剂在德国上市,在中国未进口,但原研厂家和国内合作生产了该注射剂,这是否算作地产化?注册分类应该是新3类还是新4类?
A6: 这不算地产化,因为原研未在国内上市,注册分类应为3类。
Q7: 原研进口在中国上市的注册证已过期,没有查到新的再注册批件,我们做仿制按哪一类申报?
A7: 应按4类申报,因为3类和4类的划分主要看CDE是否有该品种的临床数据。
Q8: 国产自研已批准的2类新药未进入上市药品目录集,也无参比制剂信息,想做这类产品应如何定义注册分类?
A8: 可以按仿制4类定义,但可能会遇到没有参比制剂可选的问题。
Q9: 参比制剂有两个规格,大规格原研已进口,小规格未进口,如果仿制两个规格,小规格是否可以按4类仿制药?
A9: 如果大小规格参比制剂的适应症和用法用量一致,那么未进口的小规格可以按4类仿制药进行申报。
Q10: 注册申报时选择的参比是未进口原研,申报注册3类,但在申报完成后国家发布了参比目录,包含国内进口原研,我们的化学药品注册分类是否需要改变?
A10: 不需要改变,注册分类依据是原研是否进口,申报资料递交后,国家发布的参比制剂目录不影响已确定的注册分类。
Q11: 曾有原研制剂进口,因非安全性原因已在中国撤市,现购买国外上市原研制剂进行仿制研发申报,应按照哪一类申报?
A11: 应按照4类申报。
Q12: 化药新增适应症是新报IND还是报补充申请?
A12: 如果增加的是国内外已上市药品的新适应症,按补充申请处理;如果是国内外均未上市的新适应症,则按2.4类新药申报IND。
Q13: 美国市场原研有普通片和口崩片,均未在中国申请进口,但已列入中国参比制剂目录,申报口崩片的生产注册分类是否为4类?
A13: 注册分类应为3类,因为BE可能已足够,不太可能需要批临床。
Q14: 一个2.2类改良型新药,在原剂型的适应症基础上再加四个其他适应症,申请临床时注册分类是都选2.2,还是原适应症选2.2,新适应症选2.4?
A14: 应同时选择2.2类和2.4类。44号公告说了要一并勾选。
Q15: 预灌充注射器的产品,是属于药械组合还是纯药品?
A15: 属于药品,但按照药械组合进行申报。
Q16: 原研已进口,但国内仿制申报上市按3类申报,这是什么原因?能按4类报吗?
A16: 可能是因为原研再注册证过期或未上参比制剂目录。具体情况可以参考CDE一般技术问题解答。
Q17: 治疗性细胞药物FDA药品注册时,临床3期后是按BLA申请还是NDA申请?
A17: 需要根据品种情况确定申请类型,可能需要申请Pre-NDA会议讨论。
Q18: 有进口受理号,注册分类是2.2,这是为什么?
A18: 这可能是因为该改良型新药境内外均未上市。
Q19: 因法规变化,原IND申报注册分类为治疗用生物制品1类变为了2.2类,已完成的非临床和临床试验是否能满足2.2类注册申报的要求?
A19: 新法实行旧法废止,需要按新法规评估原研究是否满足2.2类注册申报的要求。
Q20: 某品种,原研美国有多个规格,国内进口了部分规格,现在若以未进口的规格为参比制剂,拟立项申报,应以几类申报?
A20: 如果拟申报的规格适应症与已进口的规格一致,则为4类;如果规格不同,适应症也不同,则为3类。
Q21: 原研进口过,但放弃了批文,国内仿制药参比制剂公布了境外上市的原研,仿制药开发是按3类还是4类?
A21: 对于原研曾在国内上市且国内已有多家同品种上市的化学仿制药注册分类判断?此类情况,考虑到该品种已有中国人的完整和充分的安全性、有效性数据作参考,可按化学药品新4类进行申报。
Q22: 改变剂型,不改变给药途径,属于注册分类的哪一类?
A22: 可能属于2.2类,即含有已知活性成分的新剂型、新处方工艺、新给药途径,且具有明显临床优势的药品。
Q23: 抗体注册分类的判定。已上市的为双链+两个活性分子,现研究为相同的双链+四个活性分子,这种情况算改良型还是算新药?
A23: 根据国家药监局发布的2020版《生物制品注册分类及申报资料要求》,应该归类为改良型生物制品。
Q24: 如果申报的品种在《临床价值明确,无法推荐参比制剂的化学药品目录》中,那按照几类报?
A24: 如果申报的品种在《临床价值明确,无法推荐参比制剂的化学药品目录》中,根据国家药监局的相关规定,无参比制剂品种的注册分类可以参照境内境外是否已有该产品上市进行划分,并按照现有的仿制药注册分类申报。建议关注相关指导原则和文件的发布情况。
Q25: 原研未进口,参比制剂采用地产化原研,算仿制药几类?
A25: 应为4类。
Q26: 如果一个品种进口在国内上市但是还没有出现在参比制剂目录中,按照受理审查指南,是否可按4类申报?
A26: 如果该品种为国外仿制药进口到国内,应为3类申报。如果是原研已经进口,但不可及,为4类。
Q27: 对于原研曾在国内上市且国内已有多家同品种上市的化学仿制药注册分类判断?
A27: 考虑到该品种已有中国人的完整和充分的安全性、有效性数据作参考,可按化学药品新4类进行申报。
Q28: 对于已上市疫苗改变免疫剂量或免疫程序,改变适用人群的应按照什么类型申报?
A28: 改变免疫剂量和免疫程序属于2.5类,改变使用人群属于2.6类,应按照药物临床试验和上市许可申请通道进行申报。
Q29: 疗效明确,无法推荐参比制剂的产品,如何进行仿制药申报?
A29: 根据《化学药品注册受理审查指南(试行)》,国家药品监督管理局相关技术指导原则或文件中已确认价值明确,但原研不明确,无法确定参比制剂的品种,可按仿制药进行申报。
Q30: 国内上市的1类新药,如何进行仿制药申报?
A30: 目前国产1类新药均未列入参比制剂目录,所以也无途径进行仿制药申报,需要等待政策的出台。
Q31: 国内上市的原研药或原研地产化品种已纳入《仿制药参比制剂目录》,但制剂申请人选择未进口原研药品进行仿制,注册分类可否按4类进行申报?
A31: 根据《化学药品注册受理审查指南修订稿(征求意见稿)》,在适应症一致的前提下,可以按照化学药品4类进行申报和受理。
Q32: 有个品种的原研2002年进口,2005年退市,参比制剂目录只有美国橙皮书产品,没有进口原研产品。现在国内已有多个同品种产品上市了,且自新注册分类实施后没有别的厂家申报。这种情况我们申报的话,注册分类是按3类还是4类?
A32: 分析可能是4类,因为原研已在国内上市,但参比制剂目录没有收载,可能是可及性不符合要求。
Q33: 原研曾在国内获批,但进口注册证4个月内注销,像这类品种是按3类还是4类申报?
A33: 应为4类。
Q34: 有个品种的原研2002年进口,2005年退市,参比制剂目录只有美国橙皮书产品,没有进口原研产品。现在国内已有多个同品种产品上市了,注册分类是按3类还是4类?
A34: 应为4类,因为原研已在国内上市,但参比制剂目录没有收载。
Q35: 我们有个生物制品,其菌种对应的目的基因都和原研药一致,但是新发现了这个产品的适应症,我们正在做工艺开发。申报时,不保留原研药点适应症,只报新增的这个适应症,我们应该按照生物制品几类申报?
A35: 参考贝伐,按新药走。
Q36: 3类药申报过程中,原研进口获批了,最后批准会是3类还是4类?
A36: 目前按照报什么批什么的原则,是3类。
Q37: 已上市生物制品新增适应症,要走临床试验申请途径,想要获得Ⅲ期临床批件,应该按照哪个法规提交什么资料?
A37: 增加境内外均未获批的新适应症和/或改变用药人群为治疗用生物制品注册分类2.2类,申报资料要求参照国家局2020年第43号《生物制品注册分类及申报资料要求》。
Q38: 目前国内2类药品批准上市,这些药目前没有参比制剂地位,其他企业做类似的改良的话,按几类报?
A38: 按2类报,因为没有参比制剂,其他企业无法仿制。
Q39: 对于原研曾经在国内上市且国内已有多家同品种上市的化学仿制药注册分类判断?
A39: 可按化学药品新4类进行申报。
2007版、2016版、2020版分类整理图
PS:点击右键-另存为-高清大图下载
药融云-中国药品审评数据库-药品注册分类2007
药融云-中国药品审评数据库-药品注册分类2016&2020